Electronii se comportă ca undele
Fizicienii știu de mult că lumina este o undă electromagnetică. Până în prezent, nimeni nu se îndoiește de această poziție, deoarece lumina demonstrează în mod clar toate semnele comportamentului undelor: undele luminoase se pot suprapune între ele, generând un model de interferență, ele sunt, de asemenea, capabile să se separe, aplecându-se în jurul obstacolelor de-a lungul timpului de difracție.
Când vedem o pasăre care se plimbă ca o rață, înoată ca o rață și șarlată ca o rață, numim acea pasăre o rață. Deci lumina este unde electromagneticepe baza semnelor observate obiectiv ale comportamentului unei astfel de unde în lumină.

Cu toate acestea, la sfârșitul secolului al XIX-lea și al XX-lea, fizicienii urmau să înceapă să vorbească despre „dualismul particule-undă” al luminii. Se pare că știința că lumina este o undă electromagnetică nu este tot ceea ce știe știința despre lumină. Oamenii de știință au descoperit o caracteristică foarte interesantă în lumină.
Se dovedește că cumva lumina se manifestă ca comportamentul unui flux de particule cumva.S-a constatat că energia transportată de lumină, după ce a fost numărată într-o anumită perioadă de timp de către un detector special, se dovedește a fi compusă oricum din bucăți individuale (întregi).
Prin urmare, a devenit adevărat că energia luminii este discretă, deoarece este compusă, parcă, din particule individuale - „quanta”, adică din cele mai mici porțiuni întregi de energie. O astfel de particulă de lumină, purtând o unitate (sau cuantică) de energie, a ajuns să fie numită foton.
Energia unui foton se găsește prin următoarea formulă:
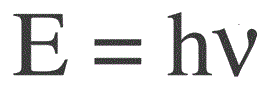
E — energia fotonului, h — constanta lui Planck, v — frecvența.
Fizicianul german Max Planck a stabilit pentru prima dată în mod experimental faptul discretității undei luminoase și a calculat valoarea constantei h, care apare în formula de găsire a energiei fotonilor individuali. Această valoare s-a dovedit a fi: 6,626 * 10-34 J * s. Planck a publicat rezultatele muncii sale la sfârșitul anilor 1900.

Luați în considerare, de exemplu, o rază violetă. Frecvența unei astfel de lumini (f sau v) este 7,5 * 1014 Hz constanta lui Planck (h) este 6,626 * 10-34 J * s. Aceasta înseamnă că energia fotonului, (E), caracteristică culorii violet, este de 5 * 10-19 J. Aceasta este o porțiune atât de mică de energie încât este foarte dificil de captat.
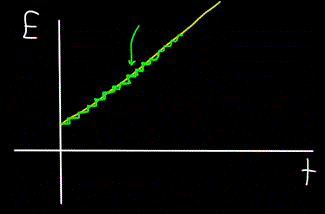
Imaginați-vă un pârâu de munte - curge ca o singură unitate și este imposibil să vedeți cu ochiul liber că fluxul este de fapt alcătuit din molecule individuale de apă. Astăzi, însă, știm că obiectul macroscopic — fluxul — este de fapt discret, adică este format din molecule individuale.
Aceasta înseamnă că, dacă putem plasa un contor de molecule lângă flux pentru a număra moleculele de apă care trec pe lângă curgerea fluxului, detectorul va număra întotdeauna doar un număr întreg de molecule de apă, nu pe cele parțiale.
În mod similar, graficul energiei totale a fotonului E, calculat la momentul t — se va dovedi întotdeauna a nu fi liniar (cifră galbenă), ci treptat (cifră verde):
Deci, fotonii se mișcă, transportă energie, prin urmare au impuls. Dar un foton nu are masă. Atunci cum poți găsi impuls?
De fapt, pentru obiectele care se deplasează cu viteze apropiate de viteza luminii, formula clasică p = mv este pur și simplu inaplicabilă. Pentru a înțelege cum să găsim impuls în acest caz neobișnuit, să ne întoarcem la relativitatea specială:
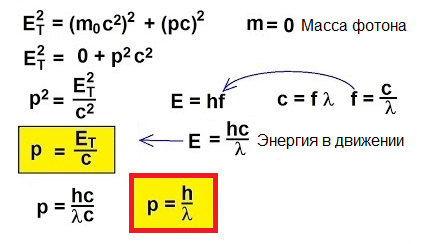
În 1905, Albert Einstein a explicat din acest punct de vedere efect fotoelectric… Știm că placa de metal are în ea electroni, care în interiorul ei sunt atrași de nucleele încărcate pozitiv ale atomilor și, prin urmare, sunt reținuți în metal. Dar dacă străluciți o astfel de placă cu lumină de o ANUMITE frecvență, atunci puteți elimina electronii din placă.
Este ca și cum lumina se comportă ca un flux de particule cu impuls și, deși un foton nu are masă, totuși interacționează cumva cu un electron dintr-un metal și, în anumite condiții, un foton este capabil să elimine un electron.
Deci, dacă un foton incident pe placă are suficientă energie, atunci electronul va fi scos din metal și va fi îndepărtat din placă cu viteza v. Un astfel de electron eliminat se numește fotoelectron.
Deoarece electronul eliminat are o masă cunoscută m, va avea o anumită energie cinetică mv.
Energia fotonului, atunci când a acționat asupra metalului, este transformată în energia de ieșire a electronului din metal (funcția de lucru) și în energia cinetică a electronului, posesoare de care electronul knocked începe să se miște din metal, lăsând-o.
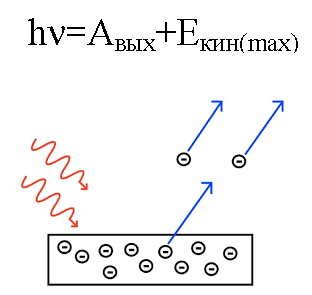
Să presupunem că un foton de lungime de undă cunoscută lovește suprafața unui metal pentru care este cunoscută funcția de lucru (a unui electron din metal). În acest caz, energia cinetică a unui electron emis de un metal dat poate fi găsită cu ușurință, precum și viteza acestuia.
Dacă energia fotonului nu este suficientă pentru ca electronul să îndeplinească funcția de lucru, atunci electronul pur și simplu nu poate părăsi suprafața metalului dat și fotoelectronul nu se formează.
În 1924, un fizician francez Louis de Broglie a prezentat o idee revoluționară conform căreia nu numai fotonii luminii, ci și electronii înșiși se pot comporta ca undele. Omul de știință a derivat chiar și o formulă pentru lungimea de undă ipotetică a electronului. Aceste valuri au fost numite ulterior „valuri de Broglie”.
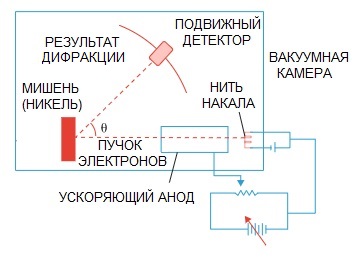
Ipoteza lui De Broglie a fost confirmată ulterior. Un experiment de fizică privind difracția electronilor, realizat în 1927 de oamenii de știință americani Clinton Davison și Lester Germer, a evidențiat în cele din urmă natura ondulatorie a electronului.
Când un fascicul de electroni a fost direcționat printr-o structură atomică specială, se pare că detectorul ar fi trebuit să înregistreze imaginea ca particule zburând una după alta, ceea ce s-ar fi așteptat în mod logic dacă electronii ar fi particule.
Dar în practică avem o imagine caracteristică difracției undelor. Mai mult, lungimile acestor unde sunt complet în concordanță cu conceptul propus de de Broglie.
În cele din urmă, ideea lui de Broglie a făcut posibilă explicarea principiului modelului atomic al lui Bohr, iar mai târziu a făcut posibil ca Erwin Schrödinger să generalizeze aceste idei și să pună bazele fizicii cuantice moderne.
